Kolorektalinė karcinoma
| Kolorektalinė karcinoma | |
 Operacija pašalintame žarnos preparate matomas išopėjęs navikas. | |
| ICD-10 | C18-C20/C21 |
|---|---|
| ICD-9 | 153.0-154.1 |
| ICD-O | 8140/3 |
| LigųDB | 2975 |
Kolorektalinė karcinoma (storosios žarnos adenokarcinoma) – dažniausias storosios žarnos piktybinis navikas, viena dažniausių vėžio formų: trečiasis pagal dažnumą vyrams (po plaučių vėžio ir prostatos vėžio) ir antrasis pagal dažnumą moterims (po krūties vėžio). Storosios žarnos adenokarcinoma sudaro didžiąją dalį storosios žarnos vėžio atvejų, ji diagnozuojama kolonoskopijos tyrimu.
Pradinėse ir vietiškai pažengusiose stadijose kolorektalinė karcinoma efektyviai gydoma kombinuojant operaciją, priešvėžinius vaistus ir radioterapiją, šitaip pavyksta išgydyti daug ligonių. Net ir pažengusiose stadijose, kai pasveikimo pasiekti neįmanoma, galimas efektyvus gydymas priešvėžiniais vaistais ženkliai prailginant ligonio išgyvenamumą ir sumažinant ligos simptomus.
Prevencija ir rizikos faktoriai[redaguoti | redaguoti vikitekstą]
Epidemiologiniai tyrimai rodo, kad riziką susirgti kolorektaline karcinoma didina:
- Nepakankamas fizinis aktyvumas[1]. Nuo 30 iki 60 minučių per dieną trunkantis fizinis aktyvumas pakankamas sumažinti ligos riziką maždaug 30%.
- Nutukimas ir antsvoris [2]: didesnis nei 25 kg/m² kūno masės indeksas padidina riziką susirgti, ši rizika santykinai didesnė vyrams negu moterims ir padidėja iki dviejų kartų.
- Tabako rūkymas[3] padidina riziką susirgti storosios žarnos vėžiu du kartus.
- Nepakankamas skaidulų ir balastinių medžiagų kiekis maiste. Tyrimai parodė, jog didesnis nei 30 gramų per dieną skaidulų kiekis maiste sumažina riziką susirgti 30%[4].
- Alkoholio vartojimas. Keturiolikos prospektyvinių tyrimų metaanalizė parodė, kad jau 100 gramų alkoholio per savaitę padidina riziką susirgti kolorektaline karcinoma 15%[5]. Rizika priklauso nuo etilo alkoholio kiekio, o ne nuo suvartojamų gėrimų rūšies.
- Raudonos mėsos ir jos produktų vartojimas padidina riziką susirgti kolorektaline karcinoma, ypač dideliais kiekiais vartojant kiaulieną, jautieną, avieną ir jų rūkytus produktus[6]. Tarp paukštienos ir jos produktų tokio ryšio nenustatyta.
- Yra daug tyrimų ir metaanalizių, analizuojančių žuvies suvartojimą, kuriuose nustatyta tendencija rodo, jog žuvis gali mažinti kolorektalinės karcinomos riziką, tačiau tyrimų duomenų nepakanka galutinėms išvadoms. Panaši situacija ir su juoda ar žalia arbata ir kava – metaanalizės neparodė jokio patikimo ryšio tarp šių produktų ir storosios žarnos vėžio rizikos[7].
- Vitaminų, maisto papildų ir mikroelementų vartojimas neturi įtakos storosios žarnos vėžio rizikai[8]. Yra keletas studijų, kurios nustatė galimą apsaugantį kalcio papildų poveikį nuo storosios žarnos adenomų, tačiau patikimo kolorektalinės karcinomos rizikos sumažėjimo nei kalciui, nei vitaminui D nenustatyta. Beta-karotino, vitamino A ir vitamino E turintys maisto papildai minėtoje metaanalizėje netgi padidino mirtingumą. Tyrimų rezultatai šioje srityje prieštaringi ir negali būti vienareikšmiškai vertinami.
- Nuo 2010 m. pasirodė nemažai studijų, analizuojančių įvairių medikamentų poveikį kolorektalinės karcinomos rizikai. Retrospektyvinės studijos ir metaanalizės rodo, kad statinai[9], aspirinas, kiti nesteroidiniai vaistai nuo uždegimo[10], pakaitinė hormonų terapija galimai neženkliai sumažina riziką susirgti, tačiau prospektyvinių tyrimų trūkumas ir šių vaistų nepageidaujami poveikiai neleidžia rekomenduoti jų vartojimo šios ligos profilaktikai.
Epidemiologija[redaguoti | redaguoti vikitekstą]

Tyrimai rodo, kad rizika susirgti kolorektaline karcinoma ima ženkliai augti sulaukus 50 metų ir toliau greitai didėja su amžiumi[11]. Lietuvoje per metus diagnozuojama apie 1500 naujų storosios žarnos vėžio atvejų ir apie 1000 žmonių miršta nuo šios ligos. Tarp moterų tai antras pagal dažnumą vėžys, sudarantis 13,1% atvejų, tarp vyrų trečias pagal dažnumą (12,8%)[12]. Vyrams kolorektalinė karcinoma diagnozuojama dažniau negu moterims.
Pasaulyje per metus kolorektaline karcinoma suserga daugiau nei 1 milijonas žmonių[13]. Sergamumas skirtingose šalyse nevienodas ir skiriasi iki 10 kartų. Didžiausias sergamumas yra Australijoje, Naujojoje Zelandijoje, Europoje, o mažiausias Afrikoje ir pietinėje Azijoje.
Patogenezė[redaguoti | redaguoti vikitekstą]

Storosios žarnos vėžys vystosi iš lėto iš normalios žarnyno gleivinės epitelio ląstelių. Palaipsniui didėjant mutacijų skaičiui normali žarnos gleivinės ląstelė virsta adenoma, iš kurios išsivysto karcinoma. Supaprastintai ląstelės lygmenyje šį virsmą galima aprašyti tokiais žingsniais[14]:
- Normalus žarnos epitelis
- Hiperplastinis epitelis: 5q mutacija, APC praradimas
- Ankstyva adenoma: 12p, Ras mutacijos
- Tarpinė adenoma: 18q mutacija, DCC praradimas
- Brandi adenoma: 17p mutacija, p53 geno inaktyvinimas
- Adenokarcinoma
Kolorektalinės karcinomos ląstelėse randama stebinančiai mažai tikrųjų onkogenų ar naviko supresorinių genų mutacijų, kur kas dažniau nustatomi epigenetiniai pakitimai, pavyzdžiui, mikro-RNR ekspresijos pokyčiai, dėl kurių slopinami ar aktyvinami tam tikri genai[15]. Pagrindinė mutacija, randama beveik visuose storosios žarnos adenokarcinomos navikuose yra APC geno mutacija. Pagal šį geną sintetinamas APC baltymas, kurio pagrindinė funkcija yra baltymo beta-katenino sintezės slopinimas. Beta kateninas skatina kai kurių genų aktyvumą ir transkripciją, o jų nestabdant labai padidėja transformacijos į karcinomą rizika.
Vis daugėja duomenų apie vadinamąjį lauko efektą: polipai ir kiti ikivėžiniai pakitimai žarnos gleivinėje randami tiek pavieniui, tiek grupėmis, neretai greta naviko nustatoma adenoma ir kiti hiperplastiniai pakitimai, todėl manoma, kad tam tikrame gleivinės plote besikaupiančios mutacijos ir epigenetiniai pakitimai didina vėžio išsivystymo riziką ir vieni kitus papildo[16].
Rizikos grupės[redaguoti | redaguoti vikitekstą]
Kolorektaliniu vėžiu sergančiųjų giminaičiai[redaguoti | redaguoti vikitekstą]
Nuo 20 iki 30% ligos atvejų stebima padidėjusi kolorektalinės karcinomos rizika šeimoje nerandant jokių genetinių pakitimų, šiais atvejais kalbama apie šeiminį kolorektalinį vėžį[17]. Tokiose šeimose pirmos eilės giminaičiams (broliams, seserims, tėvams, vaikams) rizika susirgti kolorektaline karcinoma padidėja 2–3 kartus. Jei sergančiam šeimos nariui diagnozė nustatyta jaunesniam nei 60 metų, arba šeimoje yra daugiau sergančiųjų, rizika padidėja 3–4 kartus[18]. Šiems pacientams rekomenduojama profilaktinis kolonoskopijos tyrimas nuo amžiaus, kuriame diagnozuotas anksčiausias kolorektalinės karcinomos šeimoje atvejis.
Pacientų, kuriems diagnozuota adenoma, giminaičiai[redaguoti | redaguoti vikitekstą]
Pirmos eilės pacientų, kuriems iki 50 metų amžiaus buvo diagnozuota storosios žarnos adenoma, giminaičiams rizika susirgti kolorektaline karcinoma padidėja maždaug 2 kartus[19].
Paveldima kolorektalinė karcinoma[redaguoti | redaguoti vikitekstą]
Paveldima kolorektalinė karcinoma sudaro nedidelę visų atvejų dalį (mažiau nei 5%), tačiau neretai nediagnozuojama, kadangi apie ją nepagalvojama. Išskiriamos tokios ligos grupės:
- Paveldima kolorektalinė karcinoma be polipozės, angl. HNPCC (Linčo sindromas)
- Šeiminė adenomatozinė polipozė, angl. FAP, kuri skirstoma į specifines formas (klasikinė, atenuota, su MUTYH geno mutacija ir kt.)
Šiems pacientams vėžio rizika padidėjusi kelis šimtus kartų, todėl būtina taikyti kur kas dažnesnius profilaktinius tyrimus ir intensyvų stebėjimą.
Lėtinėmis uždegiminėmis žarnyno ligomis sergantys pacientai[redaguoti | redaguoti vikitekstą]
Sergant opiniu kolitu ir Krono liga nustatytas kolorektalinės karcinomos rizikos padidėjimas, todėl rekomenduojama kolonoskopija bent kartą per metus.
Klasifikacija[redaguoti | redaguoti vikitekstą]
Anatominis skirstymas[redaguoti | redaguoti vikitekstą]
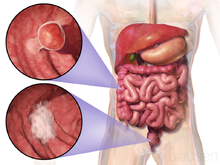
Storoji žarna sudaryta iš keleto anatominių dalių, praktinę reikšmę turi kolorektalinės karcinomos skirstymas į gaubtinės ir riestinės žarnos vėžį ir tiesiosios žarnos vėžį. Pagal šį skirstymą pasirenkama vėžio gydymo taktika, kuri abiem atvejais skiriasi. Situaciją kiek apsunkina Europoje ir JAV taikomi skirtingi šių lokalizacijų vėžio apibrėžimai.
Tarptautinė klasifikacija išskiria tiesiosios žarnos vėžį pagal atstumą nuo išeinamosios angos[20]:
- Apatinio tiesiosios žarnos trečdalio navikai: <6 cm
- Vidurinio tiesiosios žarnos trečdalio navikai: 6–12 cm
- Viršutinio tiesiosios žarnos trečdalio navikai: 12-16 cm
JAV taikoma klasifikacija tiesiosios žarnos navikams priskiria vėžį žemiau 12 cm, visi navikai, esantys aukščiau 12 cm ribos priskiriami riestinės ir gaubtinės žarnos vėžiui[21].
Stadija[redaguoti | redaguoti vikitekstą]
Nustatoma pagal tarptautinę UICC TNM klasifikaciją. Patologinės stadijos nustatymui operacijos metu turi būti pašalinta ne mažiau kaip 12 limfmazgių.
| Stadija (2010, UICC) | T | N | M | Ligonių išgyvenamumas po 5 metų nuo diagnozės[22] |
|---|---|---|---|---|
| Stadija 0 | Tis | N0 | M0 | |
| Stadija I | T1, T2 | N0 | M0 | 97,1% |
| Stadija II | T3, T4 | N0 | M0 | |
| IIA | T3 | N0 | M0 | 87,5% |
| IIB | T4a | N0 | M0 | 71,5% |
| IIC | T4b | N0 | M0 | 71,5% |
| Stadija III | bet kuris T | N1, N2 | M0 | |
| IIIA | T1, T2 | N1 | M0 | 87,7% |
| IIIA | T1 | N2a | M0 | |
| IIIB | T3, T4 | N1 | M0 | 68,7% |
| IIIB | T2, T3 | N2a | M0 | |
| IIIB | T1, T2 | N2b | M0 | 75% |
| IIIC | T4a | N2a | M0 | |
| IIIC | T3, T4a | N2b | M0 | 47,3% |
| IIIC | T4b | N1, N2 | M0 | 50,5% (T4N1) ir 27,1% (T4N2) |
| Stadija IV | bet kuris T | bet kuris N | M1 | 8,1% |
| IVa | bet kuris T | bet kuris N | M1a | |
| IVb | bet kuris T | bet kuris N | M1b |
Mikrosatelitų būklė[redaguoti | redaguoti vikitekstą]
Mikrosatelitai yra pasikartojančios DNR bazių sekos. Kolorektalinės karcinomos pagal mikrosatelitų būklę naviko ląstelėse skirstomos į:
- Mikrosatelitų stabilias (MSS)
- Mikrosatelitų mažo nestabilumo (MSI-L)
- Mikrosatelitų aukšto nestabilumo (MSI-H)
Karcinomos, kurioms nustatytas aukštas mikrosatelitų nestabilumas (MSI-H) yra kur kas geresnės prognozės, joms nustatoma kur kas mažesnė metastazavimo rizika[23]. Tyrimai rodo, kad blogai diferencijuotos kolorektalinės karcinomos (G3), kurioms nustatomas mikrosatelitų nestabilumas (MSI-H), turi kur kas geresnę prognozę, todėl klasifikuojant turėtų būti priskiriamos gerai diferencijuotų karcinomų kategorijai. Imunohistocheminis tyrimas naudojant hMLH1 ir hMSH2 žymenis patikimai atskiria aukšto mikrosatelitų nestabilumo (MSI-H) karcinomas ir gali būti taikomas kaip alternatyva brangiems genetiniams tyrimams[24].
Simptomai[redaguoti | redaguoti vikitekstą]
Simptomai priklauso nuo naviko vietos žarnyne, jo dydžio, arba, jei liga jau pažengusi – metastazių vietos. Pradinėse stadijose kolorektalinė karcinoma dažniausiai nesukelia jokių simptomų. Ligai progresuojant gali būti:
- Šviežias arba sukrešėjęs kraujas išmatose; esant navikui pradinėse storosios žarnos dalyse senas kraujas nudažo išmatas juoda spalva (vad. melena)
- Dėl kraujo praradimo kraujuojant navikui gali atsirasti anemija, kuri pasireiškia nuovargiu, silpnumu, dusuliu, fizinio krūvio netoleravimu
- Raižantis pilvo skausmas, pilnumo jausmas pilve
- Apsunkintas tuštinimasis, pasikeitusi išmatų forma
- Viduriavimas (diarėja) arba vidurių užkietėjimas (obstipacija)
- Pilvo pūtimas (flatulencija)
- Progresuojant ligai mažėja kūno svoris, ilgai sergant vystosi kacheksija
- Retais žarnos sienelę peraugęs navikas gali sukelti jos trūkimą-perforaciją, tokiais atvejais ligonis skundžiasi stipriu pilvo skausmu
- Jei vėžys perauga žarną ir ja nebegali praeiti maisto medžiagos, vystosi žarnyno nepraeinamumas
Diagnostika[redaguoti | redaguoti vikitekstą]

Profilaktiniai tyrimai ir ankstyva diagnostika[redaguoti | redaguoti vikitekstą]
Ankstyvai diagnostikai naudojami tyrimai yra tie patys. Profilaktikai šiuos tyrimus rekomenduojama atlikti nuo 50 metų amžiaus.
- Kolonoskopija yra pagrindinis tyrimas, taikomas kolorektalinės karcinomos profilaktikai ir diagnostikai. Tai didžiausią jautrumą ir specifiškumą turintis tyrimas, iki šiol laikomas aukso standartu. Kolonoskopijos metu nustatomas ne tik vėžys, bet ir adenomos – ikivėžiniai pakitimai, kurias tyrimo metu galima nesunkiai pašalinti. Tyrimai rodo, jog kolonoskopija geriausiai iš visų tyrimų nustato kolorektalinę karcinomą, o profilaktiškai atliekama sumažina riziką mirti dėl šios ligos[25][26]. Esant normaliems tyrimo rezultatams kolonoskopiją rekomenduojama kartoti kas 10 metų[27].
- Sigmoidoskopija yra alternatyvus tyrimas, kuris turėtų būti atliekamas ligoniams, nenorintiems visiškos kolonoskopijos. Tyrimai rodo, kad net po vienkartinės sigmoidoskopijos mirties rizika dėl kolorektalinės karcinomos sumažėja 43%, o pačios kolorektalinės karcinomos diagnozės rizika 33%[28]. Kadangi sigmoidoskopija neištiriamas visas storasis žarnynas, rekomenduojama šį tyrimą kombinuoti su slapto kraujo išmatose tyrimais. Neseniai paskelbtos japonų studijos rezultatai parodė, kad tokia kombinacija pagerina piktybinių navikų diagnostiką 10%[29].
- Slapto kraujo išmatose tyrimas yra indikuotinas jei neatliekama kolonoskopija, arba kombinacijoje su sigmoidoskopija. Tyrimas turi būti atliekamas mažiausiai kartą per metus, retesnis ištyrimas didina riziką, kad vėžys bus diagnozuotas per vėlai[30]. Esant teigiamam slapto kraujo išmatose tyrimui turi būti atliekama kolonoskopija. Tyrimai rodo, kad trys išmatų tyrimai vienas po kito padidina diagnostikos tikslumą lyginant su vienu, kadangi kai kurie storosios žarnos navikai kraujuoja epizodiškai.
- Genetiniai ir kiti išmatų tyrimai yra naujos kartos tyrimo metodai, kuriais siekiama nustatyti vėžinių ląstelių DNR ir kitus žymenis išmatose. Pirmosios studijos kol kas nepateikė geresnių už tradicinius diagnostikos metodus rezultatų, todėl šie brangūs ištyrimo metodai neturėtų būti taikomi kasdienei diagnostikai ar profilaktiniam ištyrimui.
- Kapsulinė endoskopija yra naujas tyrimo metodas, kurio nerekomenduojama naudoti kasdienei storosios žarnos vėžio diagnostikai nei profilaktikai. Mažos apimties tyrimų rezultatai neparodė šio metodo pranašumų prieš kolonoskopiją[31].
- Kompiuterinės tomografijos kolonoskopija ir magnetinio branduolio rezonanso kolonoskopija (virtuali kolonoskopija) yra nauji tyrimo metodai, kurių jautrumas ir specifiškumas dar patikimai neįrodyti, ypač nustatant nedidelius navikus ir mažas adenomas[32]. Radiologinė kolonoskopija gali būti rekomenduojama pacientams, kuriems dėl techninių priežasčių nebuvo įmanoma atlikti įprastos kolonoskopijos.

Išplitimo diagnostika[redaguoti | redaguoti vikitekstą]
Vėžio išplitimui, arba stadijos (pagal TNM klasifikaciją) nustatymui turi būti atliekami šie tyrimai:
- Anamnezė ir klinikinis ligonio ištyrimas
- Naviko žymuo: karcinoembrioninis antigenas (CEA) kraujo serume
- Pilvo organų echoskopija
- Kolonoskopija ir biopsija
- Radiologiniai tyrimai:
- Krūtinės ląstos rentgenograma
- Pilvo, kai kuriais atvejais ir krūtinės ląstos kompiuterinė tomografija, kai kuriais atvejais gali būti atliekama pozitronų emisijos tomografija
- Esant tiesiosios žarnos vėžiui: dubens organų magnetinio rezonanso tomografija ir endosonografija
- Jei vėžys sukelia ženklią stenozę ir kolonoskopija neįmanoma, galima atlikti kompiuterinės tomografijos kolonoskopiją (virtualią kolonoskopiją)[33].
Gydymas[redaguoti | redaguoti vikitekstą]
Neišplitęs gaubtinės ir riestinės žarnos vėžys[redaguoti | redaguoti vikitekstą]
Neišplitusiu vėžiu šiuo atveju vadinama kolorektalinė karcinoma be metastazių, tai atitinka I, II ir III ligos stadijas.
Operacija[redaguoti | redaguoti vikitekstą]
Atvira arba laparoskopinė chirurginė operacija yra efektyvus gydymas, padedantis išgydyti apie 80% ligonių, kuriems nustatyta II ligos stadija, ir apie 60%, kuriems diagnozuota III stadija (šiuo atveju po adjuvantinės chemoterapijos). Standartinė operacija turėtų būti (med.) mezokolinė ekscizija, pašalinant naviką ir aukščiau bei žemiau jo esančias žarnos dalis, taip pat regioninius limfinius mazgus[34]. Pašalintų limfinių mazgų skaičius tiesiogiai nulemia ligonio prognozę, ir nėra svarbu ligos pažeistų limfinių mazgų skaičius tyrimo rezultate, bet tiesiog pašalinti ir ištirti limfiniai mazgai. Daug šiuo klausimu atliktų tyrimų priėjo išvadų, kad pašalintų limfinių mazgų skaičius parodo chirurginio gydymo ir patologinio tyrimo kokybę[35].
Adjuvantinė chemoterapija[redaguoti | redaguoti vikitekstą]
Adjuvantinė chemoterapija skiriama po visiško chirurginio naviko pašalinimo. Chemoterapija nėra duodama pašalinus I stadijos naviką, ji indikuotina esant III stadijai ir prailgina ligonių išgyvenamumą[36] lyginant vien su chirurginiu gydymu. Po II stadijos naviko operacijos skiriama adjuvantinė chemoterapija naudinga tik nedidelei daliai pacientų, tyrimais nustatomas kiek ilgesnis laikas iki ligos progresavimo ir neįrodytas joks poveikis ligonių išgyvenamumui[37]. Dėl nevienareikšmiškų tyrimų duomenų sergant II stadija adjuvantinis chemoterapijos skyrimas rekomenduojamas pacientams, turintiems rizikos faktorių:
- T4 stadija
- Žarną kiaurai peraugęs (perforavęs) navikas
- Neplanuotai atlikta operacija (dėl kraujavimo, žarnyno nepraeinamumo)
- Nepakankamas pašalintų limfinių mazgų skaičius (mažiau nei 12)
Chemoterapijos preparatai adjuvantiniam gydymui[redaguoti | redaguoti vikitekstą]
- III stadijos atveju skiriama chemoterapija oksaliplatina, 5-fluoruracilu ir folinine rūgštimi, pavyzdžiui, FOLFOX schema[38]. Esant kontraindikacijų oksaliplatinai rekomenduojama chemoterapija 5-fluoruracilu (pavyzdžiui, kapecitabinu).
- II stadijos vėžiui pakanka adjuvantinio gydymo 5-fluoruracilu (arba kapecitabinu), papildomai skiriant oksaliplatiną negaunama geresnių rezultatų.
Neišplitęs tiesiosios žarnos vėžys[redaguoti | redaguoti vikitekstą]
Šiuo atveju taip pat kalbama apie I, II ir III ligos stadijas.
Priešoperacinis ir pooperacinis gydymas[redaguoti | redaguoti vikitekstą]
- I stadijos navikai gydomi tik operacija, šiuo atveju jokio kito gydymo nereikia.
- Esant II ir III stadijai indikuotina neoadjuvantinė (priešoperacinė) radioterapija arba radioterapija su chemoterapija. Tyrimai parodė, kad taikant spindulinį gydymą ir chemoterapiją prieš operaciją pasiekiami geresni rezultatai, negu skiriant šį gydymą tik pooperaciniu laikotarpiu [39].
- Vien tik spindulinis gydymas prieš operaciją gali būti pasirenkamas tiesiosios žarnos navikams, kurių chirurginis pašalinimas nesukels didesnių problemų.
- Esant dideliems navikams (cT4) ir numatant didelės apimties operaciją prasminga skirti kombinuotą gydymą radioterapija ir chemoterapija. Chemoterapijai skiriamas 5-fluoruracilas.
- Išimtį sudaro nedidelė grupė ligonių, kuriems nustatoma cT1 arba cT2 tiesiosios žarnos karcinoma ir abejotinas limfinių mazgų pažeidimas. Tokiu atveju galima operuoti ir po operacijos patvirtinus limfinių mazgų įtraukimą skirti pooperacinę (adjuvantinę) radiochemoterapiją.
- Po neoadjuvantinio gydymo chemoterapija ir radioterapija atliekamais tyrimais neberandant vėžio retais atvejais galima atsisakyti operacijos, kaip parodė nedidelės apimties Brazilijoje atlikto tyrimo rezultatai[40]. Kadangi didesnės apimties tyrimų šiuo klausimu nėra, tokie pacientai turi būti intensyviai stebimi, kadangi ligos atsinaujinimo rizika sunkiai prognozuojama.
- Jei prieš operaciją II ar III stadijos vėžiui nebuvo skirtas neoadjuvantinis gydymas, būtina jį skirti po operacijos, šis gydymas nėra toks efektyvus kaip prieš operaciją, tačiau prailgina ligonių išgyvenamumą ir sumažina ligos atsinaujinimo riziką[41]. Standartinis yra kombinuotas gydymas radioterapija ir chemoterapija, skirti tik vieną iš šių gydymo metodų reikėtų tik tada, jei yra kontraindikacijų.
- Po operacijos visiems ligoniams, kuriems diagnozuota II ir III stadija reikalinga adjuvantinė chemoterapija, nepriklausomai nuo naviko stadijos po priešoperacinio gydymo. Standartinis gydymas šiuo atveju yra 5-fluoruracilas.
- Svarbi ligonių grupė, kuriems diagnozuotas viršutinio tiesiosios žarnos trečdalio (nuo 12 iki 16 cm) vėžys. Kai kurie tyrimai rodo, kad ši pacientų grupė neturi naudos iš priešoperacinio spindulinio gydymo, todėl jie turėtų būti gydomi kaip gaubtinės ir riestinės žarnos vėžys: operacija ir adjuvantine chemoterapija. Studijų duomenys prieštaringi, yra ir duomenų, kalbančių už šių navikų gydymą kaip ir kitų tiesiosios žarnos dalių, skiriant neoadjuvantinę radioterapiją ir chemoterapiją.
Operacija[redaguoti | redaguoti vikitekstą]
Esant T1 stadijos vėžiui pagal TNM klasifikaciją ir nepažeistiems limfmazgiams galima taikyti vien tik chirurginį naviko pašalinimą iš žarnos sienelės – endoskopinę eksciziją, išsaugant tiesiąją žarną[42]. Šiuo atveju navikas turėtų būti ne didesnis kaip 3 cm ir aukšto diferenciacijos laipsnio – mažos rizikos.
Chirurginė operacija pašalinant tiesiąją žarną ir regioninius limfinius mazgus (med. mezorektalinė rezekcija) yra pirmojo pasirinkimo gydymo metodas. Praktikoje naudojami trys lygiaverčiai operacijos metodai:
- Priekinė tiesiosios žarnos rezekcija
- Abdominoperinealinė tiesiosios žarnos ekstirpacija
- Intersfinkterinė tiesiosios žarnos rezekcija (abdominoperanalinė rezekcija)
Konkrečios technikos pasirinkimas priklauso nuo vėžio lokalizacijos ir vietinio išplitimo. Dažniausiai po operacijos suformuojama dirbtinė žarnos anga pilvo sienoje, vadinamoji stoma, kurios tikslas yra apsaugoti chirurginiu būdu suformuotą žarnos jungtį nuo tempimo ir sumažinti komplikacijų riziką[43].
Metastazavusi liga[redaguoti | redaguoti vikitekstą]
Metastazavusi liga, arba IV stadijos kolorektalinė karcinoma didžiajai daliai pacientų neišgydoma, tačiau kai kuriais atvejais kombinuojant gydymą ir taikant multimodalinę terapiją operacija, chemoterapija, radioterapija ir simptominiu gydymu pavyksta pasiekti labai gerų rezultatų. Išplitusia liga sergantys ligoniai skirstomi į tokias grupes:
- Ligoniai, turintys chirurginiu būdu pašalinamas plaučių ar kepenų metastazes
- Geros būklės ligoniai, kuriems galima ir reikia skirti intensyvų gydymą:
- Kenčiantys nuo vėžio sukeliamų simptomų dėl išplitusios ar greitai progresuojančios ligos
- Ligoniai, turintys metastazes, kurias sumažinus chemoterapiniu gydymu jos būtų potencialiai išoperuojamos
- Vyresnio amžiaus ar blogos būklės ligoniai, kuriems skirtinas neintensyvus gydymas
- Blogos būklės ligoniai, kuriems įmanomas tik simptominis gydymas
Jei žarnoje esantis navikas nesukelia ligoniui simptomų (kraujavimo, žarnų nepraeinamumo), jis neturi būti operuojamas, ligos eigoje operacija tampa neišvengiama tik 7% ligonių[44]. Išplitusios ligos atveju ligonio gyvenimo trukmę nulemia metastazės kituose organuose ir jų sukeliamos komplikacijos. Dažniausia metastazių vieta yra kepenys, todėl kepenų metastazių gydymas yra vienas esminių išplitusios kororektalinės karcinomos gydymo elementų. Antra pagal dažnumą metastazių vieta yra plaučiai.
Kepenų ir plaučių metastazių gydymas[redaguoti | redaguoti vikitekstą]
Esant galimybei kepenų ir plaučių metastazės turi būti pašalinamos chirurgine operacija, pavykus jas visiškai pašalinti paciento prognozė ženkliai pagerėja – 5 metus išgyvena 25–40% ligonių[45]. Deja, kepenų operacija būna galima tik 15-20% ligonių, kitiems radikaliai išoperuoti kepenų metastazių techniškai neįmanoma. Metastazių operabilumui įvertinti yra daug kriterijų, bene plačiausiai naudojama FONG schema[46].
Duomenų apie priešoperacinį ir pooperacinį ligonių gydymą chemoterapija (vadinamąją neoadjuvantinę ir adjuvantinę chemoterapiją) nepakanka, šiuo klausimu dabar vyksta keletas didelės apimties tyrimų, todėl šis sprendimas kiekvienam pacientui išlieka individualus.
Efektyvus gydymo metodas yra kepenų metastazių radiodažnuminė abliacija, ypač tais atvejais, kada metastazės chirurginiu būdu pašalinti neįmanoma arba pacientas jau yra operuotas ir dalis kepenų pašalinta. Kai kurie tyrimai rodo, kad mažesnėms kaip 3 cm dydžio kepenų metastazėms radiodažnuminės abliacijos efektas gali būti panašus kaip ir chirurginio pašalinimo[47], tačiau patikimų tyrimų, kurie leistų vienareikšmiškai atsakyti į šį klausimą, nepakanka.
Pilvaplėvės metastazių gydymas[redaguoti | redaguoti vikitekstą]
Pilvaplėvės metastazės daliai ligonių gali būti sėkmingai gydomos hipertermine intraperitonine chemoterapija (HIPEC). Tyrimas parodė, jog tinkamai atrinkus ligonius ir taikant šį sudėtingą gydymo metodą 5 metų išgyvenamumas siekia 45%[48].
Metastazavusios ligos gydymas vaistais[redaguoti | redaguoti vikitekstą]
Gydymas chemoterapija prailgina ligonių išgyvenamumą ir pagerina gyvenimo kokybę, atitolina ligos komplikacijas – tai įrodė dar 1992 metais atlikti tyrimai[49].
35% ligonių diagnozės metu nustatomos metastazės, iš jų tik 15–20% įmanoma chirurgiškai pašalinti. Nauji efektyvūs chemoterapijos protokolai leidžia daliai pacientų skiriant intensyvų gydymą sumažinti metastazes iki tokio dydžio, kad jas būtų galima pašalinti operacija. Šitaip kai kurių tyrimų duomenimis išgydomi net iki 40% operuojamų (žr. skyrių apie kepenų metastazių gydymą) ligonių. Jei paciento būklė nepakankamai gera ar jis vyresnio amžiaus, pasirenkamas mažiau intensyvus gydymas, kurio tikslas yra ne išgydyti, o kuo ilgiau kontroliuoti ligą ir atitolinti komplikacijas. Tyrimai rodo, kad chemoterapinių vaistų kombinacijos efektyvesnės negu pavieniai preparatai[50], tačiau konkretus vaistas ar kombinacija parenkama atsižvelgiant į paciento būklę, kitas ligas ir konkrečius gydymo tikslus, kurie turėtų būti aptariami su kiekvienu ligoniu prieš pradedant gydymą. Jei nėra kontraindikacijų, rekomenduojama ligoniui paeiliui skirti kiekvienos žemiau išvardintų grupių vaistus ar jų kombinacijas, šitaip pasiekiamas didžiausias gydymo efektyvumas ir netgi esant labai pažengusiai ligai 2013 metų duomenimis ligoniai išgyvena daugiau negu 30 mėnesių nuo diagnozės nustatymo.
Medikamentai ir kombinacijos[redaguoti | redaguoti vikitekstą]
- 5-fluoruracilas buvo pirmasis efektyvus preparatas, skirtas kolorektalinės karcinomos gydymui ir ženkliai prailginęs ligonių išgyvenamumą iki 6–9 mėnesių. Vėlesniuose tyrimuose kombinuojant jį su folinine rūgštimi pacientų išgyvenamumas prailgėjo iki 12 mėnesių[51]. Šiandien yra tabletinė 5-fluoruracilo forma (kapecitabinas), kuri sukelia mažiau nepageidaujamų poveikių ir vienodai efektyvi.
- Oksaliplatinos ir 5-fluoruracilo kombinacija (FOLFOX chemoterapija) padidina gydymo efektyvumą, ligos atsako dažnį iki 50% ir prailgina ligonių išgyvenamumą iki 15–20 mėnesių[52].
- Irinotekanas kombinuojamas su 5-fluoruracilu (FOLFIRI chemoterapija) rodo panašius rezultatus kaip ir kombinacijos su oksaliplatina, šias kombinacijas lyginę tyrimai nenustatė reikšmingų skirtumų[53].
- Prieš kraujagyslių endotelio augimo faktorių (angl. vascular endothelial growth factor, VEGF) nukreiptas antikūnis bevacizumabas kombinuojant jį su chemoterapijos vaistais prailgina laiką iki ligos progresavimo ir pacientų išgyvenamumą. Neseniai paskelbtais duomenimis, bevacizumabas turėtų būti toliau skiriamas pabaigus gydymą chemoterapija, tokia gydymo strategija prailgina laiką iki ligos atsinaujinimo ir ligonių išgyvenamumą. Vieno tyrimo rezultatai parodė, kad vyresnio amžiaus ligoniams efektyvus ir saugus gydymas yra bevacizumabo ir kapecitabino kombinacija[54].
- Afliberceptas yra naujas monokloninis antikūnis, kurio veikimo principas panašus kaip ir bevacizumabo. Jis tyrimuose parodė gerą efektyvumą jį skiriant progresuojančiam po gydymo vėžiui kombinacijoje su chemoterapija[55].
- Cetuksimabas ir panitumumabas yra monokloniniai antikūniai, efektyvūs vaistai kolorektalinės karcinomos gydymui, kai nenustatomos RAS mutacijos. Jie paprastai skiriami kombinuojant su chemoterapija, tačiau efektyvūs ir skiriami vieni.[56]
- Regorafenibas yra 2013 metais gydymui pradėtas taikyti tirozinkinazių inhibitorius, skiriamas gydymui jei vėžys progresuoja po gydymo chemoterapija ir kitais priešvėžiniais vaistais. Regorafenibas veikia daugiau taikinių, nei biologinės terapijos vaistai (bevacizumabas, afliberceptas, cetuksimabas, panitumumabas)
Šaltiniai[redaguoti | redaguoti vikitekstą]
- ↑ Kirkegaard, H., et al. Association of adherence to lifestyle recommendations and risk of colorectal cancer: a prospective Danish cohort study. BMJ, 2010. 341. http://www.bmj.com/content/341/bmj.c5504?view=long&pmid=20978063
- ↑ Giovannucci. Modifiable risk factors for colon cancer. Gastroenterol Clin North Am, 2002. 31. http://www.ncbi.nlm.nih.gov/pubmed/12489270
- ↑ Botteri, E., et al. Smoking and colorectal cancer: a meta-analysis. JAMA, 2008. 300 (23). http://jama.jamanetwork.com/article.aspx?articleid=183086
- ↑ Dahm et al. Dietary fiber and colorectal cancer risk: a nested case – control study using food diaries. J Natl Cancer Inst, 2010. 102 (9). http://jnci.oxfordjournals.org/content/102/9/614.long
- ↑ Moskal et al. Alcohol intake and colorectal cancer risk: a dose-response meta-analysis of published cohort studies. Int J Cancer, 2007. 120. http://onlinelibrary.wiley.com/doi/10.1002/ijc.22299/abstract;jsessionid=D10A48C2B31B518DFD7E45F38A1DDFD6.f04t01
- ↑ Sinha et al. Meat, meat cooking methods and preservation, and risk for colorectal adenoma. Cancer Res, 2005. http://cancerres.aacrjournals.org/content/65/17/8034.long
- ↑ Zhang et al. Risk of colon cancer and coffee, tea, and sugar – sweetened soft drink intake: pooled analysis of prospective cohort studies. J Natl Cancer Inst, 2010. http://jnci.oxfordjournals.org/content/102/11/771.long
- ↑ Bjelakovic et al. Mortality in randomized trials of antioxidant supplements for primary and secondary prevention: systematic review and meta – analysis. JAMA. 2007 Feb 28;297(8):842-57. http://jama.jamanetwork.com/article.aspx?articleid=205797
- ↑ Bardou et al. Effect of statin therapy on colorectal cancer. Gut, 2010. 59(11). http://gut.bmj.com/content/59/11/1572.long
- ↑ Routine aspirin or nonsteroidal antiinflammatory drugs for the primary prevention of colorectal cancer: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med, 2007. 146(5). http://www.ncbi.nlm.nih.gov/pubmed/17339621
- ↑ Winawer et al., Colorectal cancer screening: clinical guidelines and rationale. Gastroenterology, 1997. 112(2).http://www.ncbi.nlm.nih.gov/pubmed/9024315
- ↑ Valuckas et al. Medicinos teorija ir praktika, 2009.
- ↑ Cunningham et al. Colorectal cancer. Lancet. 2010 Mar 20;375(9719):1030-47. doi: 10.1016/S0140-6736(10)60353-4. http://www.ncbi.nlm.nih.gov/pubmed/20304247
- ↑ Fearon et al. Cell 1990; 61: 759–767
- ↑ Balaguer F, Link A, Lozano JJ, et al. (August 2010). „Epigenetic silencing of miR-137 is an early event in colorectal carcinogenesis“. Cancer Res. 70 (16): 6609–18.
- ↑ Rubin H. (2011). Fields and field cancerization: the preneoplastic origins of cancer: asymptomatic hyperplastic fields are precursors of neoplasia, and their progression to tumors can be tracked by saturation density in culture" Bioessays 33: 224–231
- ↑ Jasperson et al., Hereditary and familial colon cancer. Gastroenterology, 2010. 138. http://www.gastrojournal.org/article/S0016-5085(10)00168-X/abstract
- ↑ Johns et al. A systematic review and meta-analysis of familial colorectal cancer risk. Am J Gastroenterol, 2001. 96(10). http://www.nature.com/ajg/journal/v96/n10/full/ajg2001736a.html
- ↑ Winawer et al., Risk of colorectal cancer in the families of patients with adenomatous polyps. National Polyp Study Workgroup. N Engl J Med, 1996. 334(2). http://www.nejm.org/doi/full/10.1056/NEJM199601113340204
- ↑ UICC, TNM Classification of Malignant Tumours. 6th Edition. 2002, New York: John Wiley & Sons.
- ↑ Nelson et al., Guidelines 2000 for colon and rectal cancer surgery. J Natl Cancer Inst, 2001. 93(8). http://jnci.oxfordjournals.org/content/93/8/583.long
- ↑ Gunderson et al. SEER. J Clin Oncol 2010, 28, 264–271
- ↑ Popat et al. Systematic review of microsatellite instability and colorectal cancer prognosis. J Clin Oncol, 2005. 23(3).
- ↑ Parc et al. Prognostic significance of microsatellite instability determined by immunohistochemical staining of MSH2 and MLH1 in sporadic T3N0M0 colon cancer. Gut, 2004. 53(3). http://gut.bmj.com/content/53/3/371.long
- ↑ Zauber et al., Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths. N Engl J Med, 2012. 366(8). http://www.nejm.org/doi/full/10.1056/NEJMoa1100370
- ↑ Kahi et al., Effect of screening colonoscopy on colorectal cancer incidence and mortality. Clin Gastroenterol Hepatol, 2009. http://www.cghjournal.org/article/S1542-3565(09)00006-8/abstract
- ↑ Rex et al., 5-year incidence of adenomas after negative colonoscopy in asymptomatic average-risk persons. Gastroenterology, 1996. 111(5). http://www.gastrojournal.org/article/S0016-5085(96)00471-4/abstract
- ↑ Atkin et al., Once-only flexible sigmoidoscopy screening in prevention of colorectal cancer: a multicentre randomised controlled trial. Lancet, 2010. 375(9726). http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(10)60551-X/fulltext
- ↑ Kato et al., Combination of sigmoidoscopy and a fecal immunochemical test to detect proximal colon neoplasia. Clin Gastroenterol Hepatol, 2009. 7(12). http://www.cghjournal.org/article/S1542-3565(09)00432-7/abstract
- ↑ Mandel et al., Reducing mortality from colorectal cancer by screening for fecal occult blood. Minnesota Colon Cancer Control Study. N Engl J Med, 1993. 328(19). http://www.nejm.org/doi/full/10.1056/NEJM199305133281901
- ↑ Eliakim et al., Prospective multicenter performance evaluation of the second-generation colon capsule compared with colonoscopy. Endoscopy, 2009. 41(12). https://www.thieme-connect.com/DOI/DOI?10.1055/s-0029-1215360[neveikianti nuoroda]
- ↑ de Haan et al., Diagnostic value of CT-colonography as compared to colonoscopy in an asymptomatic screening population: a meta-analysis. Eur Radiol, 2011. 21(8). http://link.springer.com/article/10.1007%2Fs00330-011-2104-8
- ↑ Neri et al., Colorectal cancer: role of CT colonography in preoperative evaluation after incomplete colonoscopy. Radiology, 2002. 223(3). http://pubs.rsna.org/doi/abs/10.1148/radiol.2233010928
- ↑ Hohenberger, W., et al., Standardized surgery for colonic cancer: complete mesocolic excision and central ligation--technical notes and outcome. Colorectal Dis, 2009. 11(4). http://onlinelibrary.wiley.com/doi/10.1111/j.1463-1318.2008.01735.x/abstract;jsessionid=0F12F003A560D99A64C44E4D419C8D2C.f04t04
- ↑ Ogino et al., Negative lymph node count is associated with survival of colorectal cancer patients, independent of tumoral molecular alterations and lymphocytic reaction. Am J Gastroenterol, 2010. 105(2). http://www.nature.com/ajg/journal/v105/n2/full/ajg2009578a.html
- ↑ O’Connell et al., Controlled trial of fluorouracil and low-dose leucovorin given for 6 months as postoperative adjuvant therapy for colon cancer. J Clin Oncol, 1997. 15(1). http://jco.ascopubs.org/content/15/1/246.long
- ↑ Gill et al., Pooled analysis of fluorouracil-based adjuvant therapy for stage II and III colon cancer: who benefits and by how much? J Clin Oncol, 2004. 22(10). http://www.ncbi.nlm.nih.gov/pubmed/15067028
- ↑ de Gramont A., C.B., M. Navarro, J. Tabernero, T. Hickish, C. Topham, A. Bonetti, P. Clingan, C. Lorenzato and T. André, Oxaliplatin/5FU/LV in adjuvant colon cancer: Updated efficacy results of the MOSAIC trial, including survival, with a median follow-up of six years. Journal of Clinical Oncology, Vol 25, 2007
- ↑ Sauer et al., Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med, 2004. 351. http://www.nejm.org/doi/full/10.1056/NEJMoa040694
- ↑ Habr-Gama et al., Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long-term results. Ann Surg, 2004. 240(4). http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1356472/
- ↑ Prolongation of the disease-free interval in surgically treated rectal carcinoma. Gastrointestinal Tumor Study Group. N Engl J Med, 1985. 312(23). http://www.nejm.org/doi/full/10.1056/NEJM198506063122301
- ↑ Sengupta, S. and J.J. Tjandra, Local excision of rectal cancer: what is the evidence? Dis Colon Rectum, 2001. 44.
- ↑ Montedori, A., et al., Covering ileo- or colostomy in anterior resection for rectal carcinoma. Cochrane Database Syst Rev, 2010(5)
- ↑ Poultsides, G.A., et al., Outcome of primary tumor in patients with synchronous stage IV colorectal cancer receiving combination chemotherapy without surgery as initial treatment. J Clin Oncol, 2009. 27. http://jco.ascopubs.org/content/27/20/3379.long
- ↑ Fong et al., Liver resection for colorectal metastases. J Clin Oncol, 1997. 15(3). http://jco.ascopubs.org/content/15/3/938.long
- ↑ Fong et al., Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg. 1999 Sep;230(3):309-18; discussion 318-21., 1999.
- ↑ Mulier, S., et al., Radiofrequency ablation versus resection for resectable colorectal liver metastases: time for a randomized trial? Ann Surg Oncol, 2008. 15(1). http://www.ncbi.nlm.nih.gov/pubmed/17906898
- ↑ Verwaal, V.J., et al., 8-year follow-up of randomized trial: cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy in patients with peritoneal carcinomatosis of colorectal cancer. Ann Surg Oncol, 2008.
- ↑ Expectancy or primary chemotherapy in patients with advanced asymptomatic colorectal cancer: a randomized trial. Nordic Gastrointestinal Tumor Adjuvant Therapy Group. J Clin Oncol, 1992. 10(6). http://jco.ascopubs.org/content/10/6/904.long
- ↑ Seymour et al., Different strategies of sequential and combination chemotherapy for patients with poor prognosis advanced colorectal cancer (MRC FOCUS): a randomised controlled trial. Lancet, 2007. 370(9582). http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(07)61087-3/fulltext
- ↑ Poon et al., Biochemical modulation of fluorouracil: evidence of significant improvement of survival and quality of life in patients with advanced colorectal carcinoma. J Clin Oncol, 1989. 7. http://www.ncbi.nlm.nih.gov/pubmed/2476530
- ↑ Giacchetti et al., Phase III multicenter randomized trial of oxaliplatin added to chronomodulated fluorouracil-leucovorin as first-line treatment of metastatic colorectal cancer. J Clin Oncol, 2000. http://jco.ascopubs.org/content/18/1/136.long
- ↑ Colucci et al., Phase III randomized trial of FOLFIRI versus FOLFOX4 in the treatment of advanced colorectal cancer: a multicenter study of the Gruppo Oncologico Dell’Italia Meridionale. J Clin Oncol, 2005. 23(22). http://jco.ascopubs.org/content/23/22/4866.long
- ↑ Cunningham et al. Bevacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label, randomised phase 3 trial. Lancet Oncol. 2013 Oct;14(11):1077-85. doi: 10.1016/S1470-2045(13)70154-2. Epub 2013 Sep 10. http://www.ncbi.nlm.nih.gov/pubmed/24028813
- ↑ Tabernero et al. Aflibercept versus placebo in combination with fluorouracil, leucovorin and irinotecan in the treatment of previously treated metastatic colorectal cancer: Prespecified subgroup analyses from the VELOUR trial. Eur J Cancer. 2013 Oct 16. pii: S0959-8049(13)00853-8. doi: 10.1016/j.ejca.2013.09.013. http://www.ncbi.nlm.nih.gov/pubmed/24140268
- ↑ Bokemeyer et al. Cetuximab plus 5-FU/FA/oxaliplatin (FOLFOX-4) versus FOLFOX-4 in the first-line treatment of metastatic colorectal cancer (mCRC): OPUS, a randomized phase II study. Journal of Clinical Oncology, 2007 ASCO Annual Meeting Proceedings Part I. Vol 25, No. 18S (June 20 Supplement), 2007:
Nuorodos[redaguoti | redaguoti vikitekstą]
- Apie Ras mutacijas ir gydymo pasirinkimą
- Nuorodų rinkinys apie kolorektalinio vėžio simptomus, diagnostiką ir gydymą (anglų kalba)
- Apžvalginis straipsnis apie chemoterapijos ir biologinės terapijos galimybes Archyvuota kopija 2013-12-07 iš Wayback Machine projekto.
- Papildoma informacija apie žarnyno vėžį
| |||||||||||||||||||
| ||||||||||||||||||||||||||||
