Antrojo periodo elementas
| |
Šiam straipsniui ar jo daliai trūksta išnašų į patikimus šaltinius. Jūs galite padėti Vikipedijai pridėdami tinkamas išnašas su šaltiniais. |
Antrojo periodo elementas – cheminis elementas antroje periodinės elementų lentelės eilutėje (periode). Periodinė lentelė turi eilutes tam, kad būtų iliustruotos pasikartojančios savybės didėjant cheminių elementų protonų skaičiui: nauja eilutė prasideda, kai cheminės savybės pradeda kartotis, taigi elementai su panašiomis cheminėmis savybėmis atsiduria viename stulpelyje.
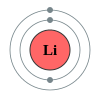
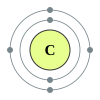
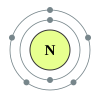
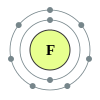
Antrasis periodas turi šiuos aštuonis elementus: litis, berilis, boronas, anglis, natris, deguonis, fluoras ir neonas. Ši skaičius aiškinamas šiuolaikinėmis atominės struktūros teorijomis. Kvantinės mechanikos atomo struktūros aprašyme šis periodas atitinka 2s ir 2p blokų bloko orbitalių užpildymus. Antrojo periodo elementai paklūsta aštuonių elektronų taisyklei – tam, kad būtų užpildytas valentinis elektronų sluoksnis, jiems reikia aštuonių elektronų. Šie elementai gali daugiausia turėti 10 elektronų: du 1s orbitalėje, du 2s orbitalėje ir šešis 2p orbitalėje. Visi šio periodo elementai, išskyrus berilį ir neoną, gali susijungti į dviatomes molekules.
Periodinės tendencijos[redaguoti | redaguoti vikitekstą]

Antrasis periodas yra pirmas periodinėje lentelėje, kuriam galima pritaikyti periodines tendencijas. Pirmasis periodas, kuriame yra vos du elementai (vandenilis ir helis) yra per mažas, kad būtų galima pamatyti besikartojančias savybes. Antrajame periode, didėjant elemento protonų skaičiui, trumpėja atomo spindulys, o elektroneigiamumas ir jonizacijos energija didėja.
Antrajame periode yra tik du metalai (litis ir berilis), taigi šis periodas turi mažiausia metalų (pirmasis periodas neturi metalų, tačiau jame yra tik du elementai, taigi jis negalėtų turėti daugiau metalų) ir daugiausia nemetalų (4). Antrojo periodo elementai savo grupėse turi ekstremaliausias savybes, pavyzdžiui, fluoras yra reaktyviausias halogenas, neonas yra inertiškiausios inertinės dujos, o litis iš šarminių metalų yra mažiausiai reaguojantis.