Aromatiniai junginiai
| |
Šiam straipsniui ar jo daliai trūksta išnašų į šaltinius. Jūs galite padėti Vikipedijai pridėdami tinkamas išnašas su šaltiniais. |
Cheminių organinių junginių klasė. Apie kvepiančiąsias medžiagas žr. straipsniuose "Kvapieji junginiai", "Aromaterapija", "Parfumerija".
Aromatiniai junginiai, dar žinomi kaip arenai – organiniai junginiai, savo molekulių struktūrose turintys paprastus benzeno žiedus, konsoliduotus benzeno žiedus arba (rečiau) kitokius aromatinius žiedus. Aromatinis žiedas yra atomų žiedas, susietas kovalentiniais ryšiais, sukuriančiais junginyje stabilias žiedines atomų struktūras. Nors į aromatinius žiedus dažniausiai jungiasi anglies atomai, gali būti įsiterpę ir kitų elementų atomų: azoto (N), deguonies (O) arba sieros (S). Junginius imta vadinti aromatiniais dėl to, kad pirmieji tokie junginiai buvo išskirti iš kvapiųjų (graikiškai 'aroma' – kvapi žolė) medžiagų (eterinių aliejų, balzamų, dervų).
Aromatiniai junginiai sudaryti tik iš anglies ir vandenilio cheminių elementų vadinami aromatiniais angliavandeniliais. Jie yra paprasčiausi ir plačiai paplitę (pvz., benzenas, toluenas, ksilenas). Aromatinių angliavandenilių struktūroje dažniausiai sutinkami benzeno žiedai.
Organinis junginys, turintis molekulėje bent vieną aromatinį atomų žiedą, laikomas aromatiniu junginiu. Toje pačioje molekulėje dar gali būti kitų aromatinių žiedų ir alifatinių ar funkcinių molekulinių grupių.
Aromatinių žiedų savybės[redaguoti | redaguoti vikitekstą]
Aromatinio žiedo elektroninė sandara[redaguoti | redaguoti vikitekstą]
Aromatinių žiedų susidarymą teoriškai galima paaiškinti šitaip: jei atomai, sudarantys aromatinį žiedą būtų atskiri (nesurišti), tipiškai jų išorinės atominės orbitalės būtų sudarytos iš vienos s orbitalės ir trijų p orbitalių. Kai kovalentinis ryšys tarp šių atomų sudaro aromatinį žiedą, viena s orbitalė ir dvi p orbitalės kiekvaname atome susijungia per sp² hibridizaciją. sp² orbitalės tarp gretimų aromatinio žiedo atomų suformuoja kovalentinius σ ryšius. Tarp gretimų kiekvienos poros atomų susidarantis σ ryšys yra molekulinio ryšio σ orbitalė, laikanti du išorinio atomo sluoksnio elektronus. Dėl šitos sp² hibridizacijos aromatiniame žiede atomai išsidėsto geometrinėje plokštumoje.
Tačiau kiekvienam atomui žiede dar pasilieka viena išorinė p orbitalė. Šitų p orbitalių skiltys yra abiejose žiedo plokštumos pusėse. Jos sudaro π ryšius. π ryšių sistema apima visą aromatinį žiedą, suformuodama skiltis abiejose aromatinio žiedo plokštumos pusėse, kur koncentruojasi elektronai. Taip susidaro π orbitalės. Būdinga, kad išoriniai elektronai lieka π orbitalėse.

Tik žemiausio energinio lygmens π orbitalė čia parodyta.
Normaliomis salygomis elektronai siekia užimti žemiausios energijos π orbitales. Šitaip yra užtikrinamas aromatinio žiedo ryšių stabilumas. π orbitalių elektronai sudaro elektronų debesis abiejose žiedo plokštumos pusėse.
Hückelio taisyklė[redaguoti | redaguoti vikitekstą]
Stabilų aromatinį žiedą sukuria ne bet koks π orbitalėse esančių elektronų skaičius. Pagal Hückelio taisyklę, kai π elektronų skaičius yra lygus 4n+2 (kur n - sveikasis skaičius, lygus 1, 2,…), ryšiai atomų žiede yra stabilizuoti ir toks žiedas yra aromatinis. Dažniausia n = 1 ir aromatiniame žiede būna 6 tokie elektronai. Kai π elektronų skaičius yra lygus 4n, žiedas nėra stabilizuotas ir vadinamas antiaromatiniu.
Cheminės struktūros išreiškimas[redaguoti | redaguoti vikitekstą]
Vienas iš paprasčiausių aromatinio junginio pavyzdžių yra benzenas, kurio cheminė formulė yra C6H6. Benzeno molekulę sudaro benzeno žiedas, sudarytas iš šešių anglies atomų, ir šešių vandenilio atomų, kurių kiekvienas surištas su vienu anglies atomu. Apie 1865 m. Friedrich August Kekulé užsibrėžė nustatyti tokią benzeno cheminės struktūros išraišką, kad ją būtų galima suderinti su kiekybine chemine formule. Jis pasiūlė struktūrą, kurią galima pavadinti 1,3,5-cikloheksatrienu arba cikloheksa-1,3,5-trienu. Čia struktūriniai ryšiai tarp 6 gretimų anglies atomų žiede vaizduojami pakaitomis viengubomis ir dvigubomis jungtimis. Kekulé pasiūlyta žiedo struktūrinė formulė ligi šiol yra dažnai naudojama vaizduojant 6 atomų aromatinį žiedą.
Alifatiniuose junginiuose vidutinis ryšio ilgis tarp anglies atomų turėtų mažėti kovalentinėms jungtims pereinant iš viengubų į dvigubus ryšius. Tačiau nustatyta, kad visi ryšiai tarp gretimų anglies atomų benzeno molekulėje yra tokie patys. Vadinasi, tikroji benzeno struktūra yra vidurkinė, o ne pakaitinė viengubų ir dvigubų ryšių struktūra.

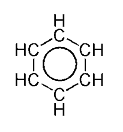
Todėl dabar dažnai vietoje trijų pakaitomis išdėstytų dvigubų ryšių, aromatinio žiedo sandara vaizduojama apskritimu, esančiu viduje šešiakampio, rodančio viengubus ryšius tarp žiedo atomų. (Žr. pav. dešinėje)
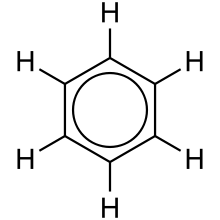
Dažnai dėl paprastumo ir cheminių struktūrų vaizdavimo lengvumo, anglies atomai nežymimi C raide, bet yra suprantama, kad kiekvienas tarpaatominius ryšius rodančio šešiakampio kampas yra anglies atomas. (Žr. pav. kairėje)
Dėl dar didesnio paprastumo, prie tokių "anglies kampų" gali būti nerodami ir H atomai. Taip gauname supaprastintą aromatinio junginio žiedo vaizdavimą.
Pakaitai ant benzeno žiedų[redaguoti | redaguoti vikitekstą]
Bet koks atomas ar molekulinė grupė gali pakeisti prie benzeno žiedo prisijungusį vandenilį. Štai keletas pavyzdžių:
- chlorobenzenas (C6H5Cl) – chloro (Cl) atomas pakeičia vieną iš H atomų benzeno molekulėje.

- fenolis (C6H5OH) – gali būti vadinamas hidroksibenzenu, nes hidroksilo grupė (-OH) pakeičia vieną iš H atomų. Pats fenolis ir junginiai, turintys bent vieną hidroksilo grupę, tiesiogiai surištą su benzeno žiedu, sudaro svarbią organinių junginių klasę, vadinamą fenoliais.
- toluenas (C6H5CH3) – gali būti vadinamas metilbenzenu, kadangi metilo grupė (-CH3) yra pakeitusi vieną iš benzeno molekulės H atomų.
Benzeno molekulėje visi H atomai yra lygiaverčiai, todėl pakeitus bet kurį vieną H atomą, susidaro tokia pati molekulė. Keičiamo vandenilio atomo padėtis pasidaro reikšminga kai pakeičiamas daugiau negu vienas benzeno molekulės vandenilio atomas. Tokiais atvejais vienam iš žiedo atomų su pakaitu paskiriamas numeris 1 ir kiti žiedo atomai nuosekliai yra sunumeruojami iki 6. Junginiai, sudaryti iš benzeno su dviem pakaitais ant žiedo, turi tris izomerus. Pavyzdžiui, yra trys ksileno izomerai (vadinami dimetilbenzenais): 1,2-dimetilbenzenas, 1,3-dimetilbenzenas, ir 1,4-dimetilbenzenas. Junginų su dviem pakaitais izomerai yra dažnai atitinkamai vadinami orto-, meta-, arba para- izomerais. Kartais šie priešdėliai trumpinami: o-, m-, ir p-. Pavyzdžiui, apačioje esančiame paveikslėlyje apibūdinti trys ksileno izomerai.

Net jei du pakaitai yra skirtingi, vis tiek yra trys izomerai, kurie gali būti pažymėti su orto-, meta-, ir para- priešdėliais; pvz., yra orto-, meta-, ir para-kresolio (kitaip metilfenolio) izomerai. Kada ant benzeno žiedo yra daugiau negu du pakaitai, taip pat yra naudojamas žiedo atomų numeravimas.
Heterocikliniai aromatiniai junginiai[redaguoti | redaguoti vikitekstą]

Organiniai junginiai, kuriuose bent vienas žiedo atomas yra ne anglis, vadinami heterocikliniais junginiais. Heterocikliniai žiedai irgi gali būti aromatiniai žiedai. Heterocikliniuose aromatiniuose žieduose dažnai randamas azotas (N). Neutralūs azoto atomai skiriasi nuo neutralių anglies atomų tuo, kad N gali suformuoti viena kovalentine jungtimi mažiau negu C, nes išoriniame sluoksnyje turi vieną elektronų porą. Aromatiniane žiede azoto elektronų pora nesudaro π ryšių, bet lieka laisva ir gali priimti H+, todėl N tokiame žiede gali veikti kaip bazė.
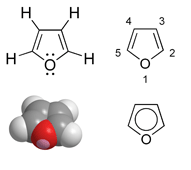
Anglies pakeitimas į atomą, turintį elektronų porą, leidžia aromatines savybes turėti kai kuriuos 5 atomų žiedus. Tokio junginio pavyzdys - furanas. Neutralus deguonies (O) atomas normaliai sudaro du kovalentinius ryšius ir turi dvi laisvas elektronų poras. Kaip dažnai parodoma furano cheminėje struktūroje, du C atomai yra susijungę viengubomis jungtimis su O ir dvigubomis- su gretimais C atomais. Susidaro visų C atomų sp² hibridizacija ir du C=C dvigubieji ryšiai, dalyvaujant dviem kiekvieno anglies atomo π orbitalės elektronams. Kad žiedas atitiktų Hückelio taisyklę ir būtų aromatinis, O atome įvyksta sp² hibridizacija ir viena iš jo elekronų porų įsijungia į π orbitalių sistemą. Taigi 6 elektronų poros atsiduria žiedo π orbitalėse, patenkinama Hückelio taisyklė ir aromatinis furano žiedas stabilizuojasi. Ši elektronų pora kartais vaizduojama cheminių struktūrų modeliuose žiedo viduje. Kita deguonies elektronų pora nedalyvauja žiedo π orbitalėse ir cheminėse formulėse gali būti parodyta žiedo išorėje.

Kitas panašus junginys - tiofenas, C4H4S, kuriame deguonis pakeistas sieros (S) atomu. Pirolo stuktūra taip pat panaši į furano, tik deguonis yra pakeistas su N-H grupe. N atomo vienintelė elektronų pora yra užtikrina aromatinio žiedo stabilumą. Todėl pirolas daug silpnesnė bazė negu panašūs alifatiniai aminai.

Policikliniai aromatiniai junginiai[redaguoti | redaguoti vikitekstą]
Aromatinius junginius gali sudaryti du ar daugiau žiedų, kai du atomai viename aromatine žiede yra dalis kito aromatinio žiedo. Paprasčiausias pavyzdys yra naftalenas (C10H8).


